お知らせ
2021年03月22日 【プレスリリース】患者由来のミニ癌(癌オルガノイド)を利用した個別化医療
患者由来のミニ癌(癌オルガノイド)を利用した個別化医療
オルガノイドと遺伝子解析を組み合わせた膵・胆道癌の個別化医療モデルを開発
オルガノイドと遺伝子解析を組み合わせた膵・胆道癌の個別化医療モデルを開発
国立大学法人東北大学
学校法人東京女子医科大学
学校法人東京女子医科大学
【研究のポイント】
・膵臓癌および胆道癌(以下、膵胆道癌)の外科切除検体から癌オルガノイド注1(三次元細胞)の高効率な培養に成功した
・腫瘍組織を用いて遺伝子の全エクソン解析注2を行い、導き出された個別化治療薬の効果を癌オルガノイドで確認した
・癌オルガノイドと遺伝子解析を用いることで、個々人に最適な治療薬を選択・検証できるシステムを開発できた
【研究概要】
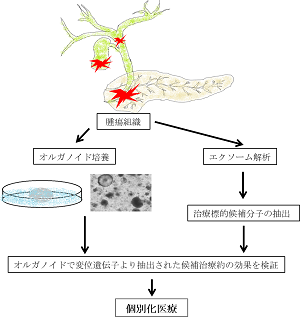 膵胆道癌は治療が難しく予後の悪い癌です。そのため、患者個々の遺伝的背景、環境、ライフスタイルを考慮し、個々人に最適な医療を提供する個別化医療が必要となってきます。今回、東北大学大学院医学系研究科病態病理学分野の椎原正尋大学院博士課程学生、古川徹教授のグループは、東北大学病院総合外科、東北大学未来型医療創成センター、及び東京女子医科大学消化器・一般外科と共同で、難治癌である膵胆道癌の個別化医療モデルを開発しました。本モデルシステムでは手術で切除された患者由来の腫瘍組織から癌オルガノイド(三次元細胞)を作成し、同時に腫瘍組織の網羅的遺伝子変異解析を行って個々の腫瘍に対し最適な治療薬候補を見出しました。実際に患者由来の腫瘍から分離培養された癌オルガノイドに候補治療薬を投与し、その効果を検証することで真に有効な治療薬の選択が可能となります。このモデルの臨床応用にむけて、システムの簡易化と適応拡大が期待されます。
膵胆道癌は治療が難しく予後の悪い癌です。そのため、患者個々の遺伝的背景、環境、ライフスタイルを考慮し、個々人に最適な医療を提供する個別化医療が必要となってきます。今回、東北大学大学院医学系研究科病態病理学分野の椎原正尋大学院博士課程学生、古川徹教授のグループは、東北大学病院総合外科、東北大学未来型医療創成センター、及び東京女子医科大学消化器・一般外科と共同で、難治癌である膵胆道癌の個別化医療モデルを開発しました。本モデルシステムでは手術で切除された患者由来の腫瘍組織から癌オルガノイド(三次元細胞)を作成し、同時に腫瘍組織の網羅的遺伝子変異解析を行って個々の腫瘍に対し最適な治療薬候補を見出しました。実際に患者由来の腫瘍から分離培養された癌オルガノイドに候補治療薬を投与し、その効果を検証することで真に有効な治療薬の選択が可能となります。このモデルの臨床応用にむけて、システムの簡易化と適応拡大が期待されます。
この研究成果は、2021年3月19日に英国の学術誌「European Journal of Cancer」に掲載されました。
【研究内容】・膵臓癌および胆道癌(以下、膵胆道癌)の外科切除検体から癌オルガノイド注1(三次元細胞)の高効率な培養に成功した
・腫瘍組織を用いて遺伝子の全エクソン解析注2を行い、導き出された個別化治療薬の効果を癌オルガノイドで確認した
・癌オルガノイドと遺伝子解析を用いることで、個々人に最適な治療薬を選択・検証できるシステムを開発できた
【研究概要】
 膵胆道癌は治療が難しく予後の悪い癌です。そのため、患者個々の遺伝的背景、環境、ライフスタイルを考慮し、個々人に最適な医療を提供する個別化医療が必要となってきます。今回、東北大学大学院医学系研究科病態病理学分野の椎原正尋大学院博士課程学生、古川徹教授のグループは、東北大学病院総合外科、東北大学未来型医療創成センター、及び東京女子医科大学消化器・一般外科と共同で、難治癌である膵胆道癌の個別化医療モデルを開発しました。本モデルシステムでは手術で切除された患者由来の腫瘍組織から癌オルガノイド(三次元細胞)を作成し、同時に腫瘍組織の網羅的遺伝子変異解析を行って個々の腫瘍に対し最適な治療薬候補を見出しました。実際に患者由来の腫瘍から分離培養された癌オルガノイドに候補治療薬を投与し、その効果を検証することで真に有効な治療薬の選択が可能となります。このモデルの臨床応用にむけて、システムの簡易化と適応拡大が期待されます。
膵胆道癌は治療が難しく予後の悪い癌です。そのため、患者個々の遺伝的背景、環境、ライフスタイルを考慮し、個々人に最適な医療を提供する個別化医療が必要となってきます。今回、東北大学大学院医学系研究科病態病理学分野の椎原正尋大学院博士課程学生、古川徹教授のグループは、東北大学病院総合外科、東北大学未来型医療創成センター、及び東京女子医科大学消化器・一般外科と共同で、難治癌である膵胆道癌の個別化医療モデルを開発しました。本モデルシステムでは手術で切除された患者由来の腫瘍組織から癌オルガノイド(三次元細胞)を作成し、同時に腫瘍組織の網羅的遺伝子変異解析を行って個々の腫瘍に対し最適な治療薬候補を見出しました。実際に患者由来の腫瘍から分離培養された癌オルガノイドに候補治療薬を投与し、その効果を検証することで真に有効な治療薬の選択が可能となります。このモデルの臨床応用にむけて、システムの簡易化と適応拡大が期待されます。この研究成果は、2021年3月19日に英国の学術誌「European Journal of Cancer」に掲載されました。
膵胆道癌は治療が難しく予後の悪い癌として知られています。その要因のひとつとして薬物治療法の選択肢が他の癌と比較して明らかに少なく、しかも、その薬剤が効く効率も低いことがあげられます。癌の発生には遺伝子変異が大きく関与し、かつ、その種類や変化の仕方が極めて多岐にわたるため、患者個々の遺伝的背景、環境、ライフスタイルを考慮し、個々人に最適な医療を提供する個別化医療が必要となってきます。特に、膵胆道癌のような治療の選択肢の少ない癌では、腫瘍個々の遺伝子解析による個別化医療が予後を改善させる打開策になると考えられています。しかし、実際に候補とした薬物がどの様な効果をもたらすかは不確定であり、その検証システムの開発が求められていました。
オルガノイドとは「ミニ臓器」と言われる三次元構造体です。従来研究で用いられてきた二次元細胞よりも生体内の細胞に近いとされ、患者の癌組織から作り出された癌オルガノイドは、癌モデルとして様々な研究への応用が期待されています。本研究では、このオルガノイドの特性を生かせば、膵胆道癌に対する個別化医療の検証システムとして用いることができるかもしれないと考えました。54人の患者から得られた癌組織の検体からオルガノイド培養を試みました。その結果、培養細胞は風船状オルガノイドと塊状オルガノイドに分類できることを見出しました。また、病理学的特徴と遺伝子変異の確認から、風船状オルガノイドは正常細胞由来のオルガノイドであり、塊状オルガノイドが真の癌オルガノイドであることが明らかとなりました。塊状の癌オルガノイドを選択的に培養していくことで、以前の報告よりも高確率で膵胆道癌由来オルガノイドを培養することに成功しました。
つぎに、今まで培養成功報告の少ない胆道癌について、腫瘍組織から抽出したDNAの全エクソン解析を行い、胆道癌には多岐にわたる様々な分子異常が関与していることが示されたものの、癌の原因となる全体に共通した遺伝子変異は認めらませんでした。この結果より、個別化の重要性が確認されました。さらに、個別の遺伝子変異プロファイルから治療標的となり得る候補分子を見出し、それらに対する特異的阻害薬の効果を患者由来の癌オルガノイドで確認することができました。特に、今回の研究では、遺伝子候補の中から胆嚢癌症例で遺伝子変異を起こしていたインテグリン結合キナーゼ注3(ILK)遺伝子に注目しました。ILK遺伝子の変異は他の癌腫では発癌に関与している報告が認められていますが、胆道癌では明らかになっていませんでした。ILKタンパク質の阻害剤を患者由来の癌オルガノイドに作用させたところ、細胞増殖が抑制され、ILKタンパク質の標的であるリン酸化AKT注4タンパク質の量が減少したことから、この患者の癌に対してこの薬剤が実際に効果を示す可能性が高いことを示すことができました。
結論:本研究成果により、癌患者由来の癌オルガノイドを癌のモデルとして使用する有効性が明らかとなり、オルガノイドの特性を生かした個別化医療システムを開発することができました。癌ゲノム医療が普及していく中で、腫瘍個々のゲノム情報に基づいた個別化医療の重要性がさらに増してきています。特に難治癌である膵胆道癌に対する個別化医療の期待は大きく、実際に患者の癌について候補薬剤の効果を検証できる本研究で開発したシステムは、より効果的な個別化医療の実践につながることが期待されます。
支援:本研究は、日本学術振興会科学研究費補助金(16H05165)、日本膵臓病研究財団の支援を受けて行われました。
【用語説明】
注1.オルガノイド:組織の特性を保ちながら生体外で増殖する三次元構造体である。もととなる臓器のミニチュア版として「ミニ臓器」と呼ばれている。癌細胞から作り出されたオルガノイドは癌オルガノイドと呼ばれ、癌研究への応用が期待されている。
注2.全エクソン解析:全ゲノムのうち、タンパク質に翻訳される領域の塩基配列を網羅的に次世代シークエンサーで解析する手法。遺伝性疾患の多くがエキソン領域の異常によって引き起こされると推測されている。
注3.インテグリン結合キナーゼ:細胞間・細胞基質間橋分子であるインテグリンと結合して働くリン酸化酵素で、がんの増殖と転移に関係する。
注4.リン酸化AKT:リン酸化酵素でILKによりリン酸化されることで活性化し、がん細胞の生存、増殖、代謝に関与する。
【論文題目】
Title: Development of a system combining comprehensive genotyping and organoid cultures for identifying and testing genotype-oriented personalized medicine for pancreatobiliary cancers.
Authors: Masahiro Shiihara, Tomohiko Ishikawa, Yuriko Saiki, Yuko Omori, Katsuya Hirose, Shinichi Fukushige, Naoki Ikari, Ryota Higuchi, Masakazu Yamamoto, Takanori Morikawa, Kei Nakagawa, Hiroki Hayashi, Masamichi Mizuma, Hideo Ohtsuka, Fuyuhiko Motoi, Michiaki Unno, Yasunobu Okamura, Kengo Kinoshita, and Toru Furukawa.
タイトル:オルガノイド培養と網羅的ゲノム解析を用いた膵胆道癌の個別化医療システムの開発
著者名:椎原正尋、石川智彦、斎木由利子、大森優子、廣瀨勝也、福重真一、碇直樹、樋口亮太、山本雅一、森川孝則、中川圭、林洋毅、水間正道、大塚英郎、元井冬彦、海野倫明、岡村容伸、木下賢吾、古川徹
掲載誌名:European Journal of Cancer
DOI:10.1016/j.ejca.2021.01.047
PDFはこちら>>
2021年03月11日 本学解剖学(顕微解剖学・形態形成学分野)石津綾子教授が「Healthy Longevity Award」を受賞
----------------------------------------
Dr. Ayako Nakamura-Ishizu (Tokyo Women’s Medical University, Microanatomy and Developmental Biology) was awarded the “Healthy Longevity Award” during the Interstellar Initiative workshop hosted by New York Academy of Sciences (NYAS) and the Japan Agency for Medical Research and Development (AMED)
The Interstellar Initiative launched jointly by of the NYAS and AMED recognizes the world’s most promising Early Career Investigators and provides a platform to foster collaboration research projects. Three competitively selected researchers are matched into interdisciplinary and intercontinental teams and receive expert guidance from leading senior scientists to formulate a competitive research proposal during a round of two workshops. The 2020-2021 Interstellar Initiative addressed challenges in the area of Healthy Longevity. Ayako Nakamura-Ishizu (Tokyo Women's Medical University) worked together with Celia Martinez-Jimenez (Helmholtz Pioneer Campus, Munich) and Weiqiang Chen (New York University) to translate mutual scientific interests and specialties into a competitive research proposal focusing on inter-organ crosstalks during organism aging. The team’s proposal gained top evaluation and was awarded the Healthy Longevity Award.

2021年03月10日 【プレスリリース】脳が完成するまでに「生き残る」回路と「刈り込まれる」回路との違いを解明
脳が完成するまでに「生き残る」回路と「刈り込まれる」回路との違いを解明
学校法人 東京女子医科大学
| Point ○ 脳は生まれた時点では未成熟で、完成するまでの過程でシナプス*1の選別と刈り込みが行われます。そこで、実際の選別が起こる前の段階で、将来生き残るシナプスと刈り込まれるシナプスがどのように異なるのかを調べました。 ○ 同じ神経細胞にシナプスを形成していても、将来生き残るシナプスは選別前から徐々に強くなるのに対し、将来刈り込まれるシナプスは未熟なままであることを突き止めました。将来生き残るシナプスの発達を制限しても、その代わりに刈り込まれるシナプスが発達するようになるわけではないことが分かりました。 ○ 今回の発見はシナプスの選別の根本的理解に迫るもので、脳の発達過程や精神神経疾患の理解へとつながることが期待されます。 |
Ⅰ 研究の背景と経緯
我々の脳機能は、シナプスと呼ばれる繋ぎ目を介して神経細胞同士が情報をやり取りすることによって成り立っています。神経細胞同士の配線(神経回路)は生後初期段階では未完成であり、発達に伴って徐々に完成していきます。この過程においてシナプスはまず過剰に創生され、その後の生育環境や経験に応じて必要なシナプスと不要なシナプスに選別されます。必要なシナプスが選別されて生き残り、不要なシナプスが刈り込まれることによって脳は精密な神経回路として成熟します。このシナプスの選別と刈り込みがうまくいかないと脳の情報処理に不具合が生じ、自閉症や統合失調症などにもつながると考えられています。ゆえに、神経回路が完成するまでの過程で、必要なシナプスと不要なシナプスにどのような性質の違いが生じ、その違いを誘導する仕組みとは何かを解明することは、精神・神経疾患の治療法開発に繋がることが期待できます。今回の研究成果は、2021年3月10日(日本時間)に米国科学雑誌Proceedings of the National Academy of Sciences of the United States of America(米国科学アカデミー紀要PNAS)のオンライン版に掲載されました。
Ⅱ 研究の内容
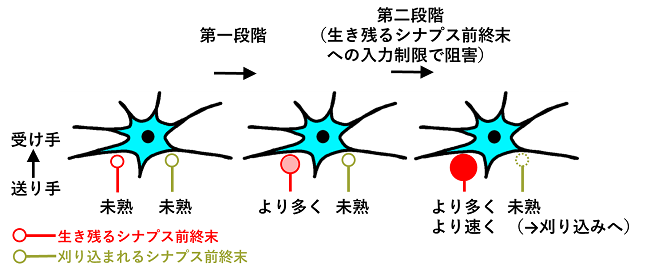
シナプスには送り手と受け手が存在しますが、送り手であるシナプス前終末は非常に小さく、その大きさは髪の毛の太さ(50から100ミクロン)の数十分の一(数ミクロン)しかありません。脳の複雑な神経回路の中で、脳全体では数十兆から数百兆にもおよぶこれらの小さなシナプス前終末のどれが生き残り、どれが刈り込まれるのかを区別してその性質を調べることは従来の方法では困難であり、神経回路が完成する前段階で両者の性質がどう違うのかよく分かっていませんでした。東京女子医科大学生理学(神経生理学分野)講座の緑川光春(みどりかわ みつはる)講師と宮田麻理子(みやた まりこ)教授は、脳内の視床という領域において、生き残るシナプス前終末と刈り込まれるシナプス前終末を別々の蛍光タンパク質で標識し、数ミクロンのシナプス前終末から直接電気応答を計測するという極めて難易度の高い手法を駆使して、実際の選別と刈り込みに至るまでの両者の発達過程の違いを調べました。生後最初期では将来生き残るシナプス前終末と刈り込まれるシナプス前終末は共に未熟でその機能に差は見られませんでしたが、その後両者は大きく異なる発達過程を見せました。将来生き残るシナプス前終末では、まず第一段階として神経伝達物質をより多く、次いで第二段階としてより速く送れるように機能が発達していったのに対し、刈り込まれるシナプス前終末ではその機能は生後最初期の未熟な状態から変わりませんでした。
発達初期には同様の性質を持ちながら、その後の運命が異なるのはなぜでしょうか?視床の神経回路は、発達過程において生き残るシナプスへの入力を制限すると本来刈り込まれるべきシナプスが生き残るようになることが先行研究によって報告されています。このことから、両者の間にはなんらかの競争が起きていて、いわゆるゼロサム関係(一方が得をするともう一方が損をする関係)にある可能性があります。そこで、生き残るシナプスへの入力を制限した場合に、シナプス前終末の発達過程がどのような影響を受けるのかを調べてみました。すると、生き残るシナプス前終末において神経伝達物質をより速く送れるようにする第二段階の発達が見られなくなりましたが、刈り込まれるシナプス前終末は相変わらず未熟なままでした。つまり、生き残るシナプス前終末と刈り込まれるシナプス前終末の間の関係はゼロサム関係ではなく、生き残るシナプス前終末への入力は両者の違いをより広げていく作用があることが分かりました。
これまで、発達途上の脳において生き残るシナプスと刈り込まれるシナプスでは何が違い、何が両者の運命を決定づけているのかはほとんど分かっていませんでした。本研究は両者の発達過程の違いを明確に示すことに成功し、これらの違いをヒントとして将来的に両者を運命づけている仕組みの解明やその操作につながる研究です。
Ⅲ 今後の展開
生後発達に伴う神経回路の成熟は、知能・感覚・運動機能が生後に著しく発達する我々ヒトにとって非常に重要です。しかし、神経回路の接続部であるシナプスの選別において、なにが決定的な要因となっているのかはよく分かっていません。本研究の発見は、シナプスを運命づけている要因の解明に向けた大きな一歩となりうるものです。将来的にシナプス選別の仕組みを理解してこれを操作できるようになれば、脳の神経回路形成の異常に端を発する様々な精神疾患の治療に役立つことが期待されます。
本研究は、日本学術振興会、文部科学省研究費補助金 JSPS KAKENHI(16H01344, 17K19466, 17H03548, 17H05752, 19H03343)、学術変革領域(A)「臨界期生物学」(20H05916)の支援を受けて行われました。
「用語解説」
1.シナプス:
神経細胞間の情報伝達が行われる接合部です。送り手にあたるシナプス前終末には神経伝達物質を蓄えているシナプス小胞が集積しており、神経細胞が興奮するとシナプス小胞が細胞膜に融合して神経伝達物質が細胞外へと放出されます。この現象を開口放出といいます。細胞外に放出された神経伝達物質が、受け手であるシナプス後細胞に作用することで情報が伝わります。
【プレス情報】
1.掲載誌名 PNAS (Proceedings of the National Academy of Sciences of the United States of America)
2.論文タイトル Distinct functional developments between surviving and eliminated presynaptic terminals DOI: 10.1073/pnas.2022423118.
3. 著者名 緑川光春、宮田麻理子
4. 論文のオンライン掲載日 2021年3月10日
PDFはこちら>>
2021年03月05日 【プレスリリース】膵臓がん発生の仕組みに迫る STK11遺伝子に異常を有する膵管内乳頭粘液性腫瘍の特徴
膵臓がん発生の仕組みに迫る
STK11遺伝子に異常を有する膵管内乳頭粘液性腫瘍の特徴
STK11遺伝子に異常を有する膵管内乳頭粘液性腫瘍の特徴
国立大学法人東北大学
医療法人徳洲会札幌東徳洲会病院医学研究所
国立大学法人旭川医科大学
学校法人東京女子医科大学
国立大学法人山形大学医学部
医療法人徳洲会札幌東徳洲会病院医学研究所
国立大学法人旭川医科大学
学校法人東京女子医科大学
国立大学法人山形大学医学部
【研究のポイント】
• 膵管内乳頭粘液性腫瘍注1におけるSTK11注2異常についてゲノム解析し、その臨床病理学的特徴を明らかにした。
• STK11の異常に関連する5つの特徴を明らかにした。
• STK11を標的とした膵臓がんの早期発見や新規治療戦略の開発が期待される。
【研究 概要】
腫瘍抑制遺伝子であるSTK11は、膵臓がんのドライバー遺伝子注3ですが、膵管内乳頭粘液性腫瘍における腫瘍化への役割は明らかではありませんでした。東北大学大学院医学系研究科病態病理学分野・大森優子助教、古川徹教授らの研究グループは、STK11異常を有する 膵管内乳頭粘液性腫瘍の遺伝学的、臨床病理学的な5つの特徴を明らかにしました。STK11を標的とした膵臓がんの早期発見や新しい治療戦略の開発につながることが期待されます。
本研究成果は、2021年3月3日米国の学術誌Annals of Surgery誌(電子版)に掲載されました。
【研究内容】
膵管内乳頭粘液性腫瘍は、粘液を産生する腫瘍細胞が膵臓の管(膵管)の中に発生し、膵管が袋状に拡張して腹痛や消化不良を起こす腫瘍です。進行すると膵臓の実質(膵液を作る細胞やインスリンを分泌する膵島など)や周囲臓器への浸潤、膵管に穴が空くこと(穿破)による腹腔内へ消化液の漏洩、さらには腫瘍細胞の遠隔転移を起こし、治療経過が悪化したりします。また、膵管内乳頭粘液性腫瘍が足場となって、硬い腫瘍を作る一般的な膵臓がんが発生したりすることが知られています。
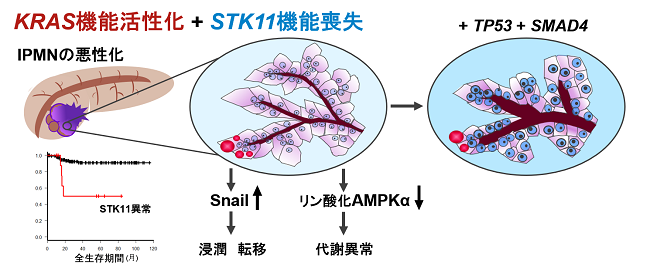
腫瘍抑制遺伝子であるSTK11は、消化管腫瘍と皮膚色素沈着を起こす遺伝性疾患であるPeutz-Jeghers症候群の原因遺伝子で、正常に働かなくなることにより、膵臓がんを含むがんの発生進行を促すドライバー遺伝子として機能します。しかし、膵管内乳頭粘液性腫瘍の発生・進行におけるその役割は明らかではありませんでした。本研究では、東北大学大学院医学系研究科病態病理学分野・大森優子(おおもり ゆうこ)助教、古川徹(ふるかわ とおる)教授らの研究グループは、同消化器外科学分野・森川孝則(もりかわ たかのり)准教授、元井冬彦(もとい ふゆひこ)准教授(現 山形大学医学部第一外科教授)、海野倫明(うんの みちあき)教授、札幌東徳洲会病院医学研究所・小野裕介(おの ゆうすけ)主任研究員、旭川医科大学医学部内科学講座がんゲノム医学部門・水上裕輔(みずかみ ゆうすけ)教授、東京女子医科大学消化器病センター消化器・一般外科・樋口亮太(ひぐち りょうた)講師、山本雅一(やまもと まさかず)教授らと共同で、膵管内乳頭粘液性腫瘍手術切除標本の病理学的解析と次世代シーケンサー注4による遺伝子解析により、STK11異常を有する膵管内乳頭粘液性腫瘍の遺伝学的、臨床病理学的特徴を明らかにしました。STK11遺伝子異常を有する膵管内乳頭粘液性腫瘍には、以下の5つの特徴があることがわかりました(図1)。
①KRAS注5の機能活性化変異と相助し、特徴的な形状の膵管内乳頭粘液性腫瘍を形成する。
②膵管内乳頭粘液性腫瘍の悪性化に関与し、治療経過を悪化させるリスク因子となる。
③既知の膵臓がんドライバー遺伝子であるTP53やSMAD4よりも先に異常が生じる。
④リン酸化AMPKα注6発現の低下により、細胞内代謝を変化させる。
⑤転写制御因子であるSnail注7タンパク質の発現の上昇により、細胞接着性を低下させ、浸潤や転移に関与する。
結論:この研究成果により、膵管内乳頭粘液性腫瘍患者の追跡観察におけるSTK11を標的とした膵臓がんの早期発見や、STK11-AMPK経路に対する新規治療戦略の開発が期待されます。
支援:本研究は日本学術振興会科学研究費(19K16576、20H03655)と艮陵医学振興助成金の支援を受けて行われました。
【用語説明】
注1.
膵管内乳頭粘液性腫瘍:膵臓にできる嚢胞(のうほう)性腫瘍の代表。膵管(膵液が流れる管)の内部に、盛り上がるよう(乳頭状)に増殖する腫瘍で、豊富な粘液分泌を特徴とする。膵管内で発育した腫瘍が、浸潤して膵臓がんを形成する。
注2.
STK11 細胞の増殖や分化、極性を制御するタンパク質。様々な生体反応の制御に関与する腫瘍抑制遺伝子で、消化管ポリポーシス(多数のポリープができる症状)と粘膜皮膚色素沈着を特徴とし、高い膵発癌リスクを有することが知られている Peutz-Jeghers症候群の原因遺伝子として有名。
注3.
ドライバー遺伝子:がん遺伝子・腫瘍抑制遺伝子といった、がんの発生・進展において直接的に重要な役割を果たす遺伝子。変異により機能を失う場合と、新たに機能を獲得する場合がある。ドライバー遺伝子は低分子阻害剤や抗体医薬など、様々な分子治療の標的として有望であり、同時に診断のマーカーにもなる。
注4.
次世代シーケンサー:大量のDNA配列を高速に解析できる技術。研究面、臨床面での応用が進んでいる。
注5.
KRAS:がん遺伝子。膵臓がんの約95%にその機能活性化変異が認められる。
注6.
AMPKα AMP活性化 プロテインキナーゼ。細胞エネルギーの恒常性維持における主要な制御因子。AMPKは、脂質およびグルコース代謝の両方で、中心的な役割を担うことから、がんの治療における治療標的となる可能性がある。
注7.
Snail遺伝子の働きを制御するタンパク質。細胞接着分子であるタンパク質E-cadherinの発現を抑ることにより、癌細胞が浸潤・転移能を獲得する第1段階である上皮間葉移行を誘導する。
図1: STK11異常を有する膵管内乳頭粘液性腫瘍(IPMN)の特徴
【論文題目】
Title: Serine/Threonine Kinase 11 Plays a Canonical Role in Malignant Progression of KRAS-mutant and GNAS-wild-type Intraductal Papillary Mucinous Neoplasms of the Pancreas
Authors: Yuko Omori, Yusuke Ono, Takanori Morikawa, Fuyuhiko Motoi, Ryota Higuchi, Masakazu Yamamoto, Yuko Hayakawa, Hidenori Karasaki, Yusuke Mizukami, Michiaki Unno, Toru Furukawa
タイトル:STK11はKRAS変異/GNAS野生型IPMNの悪性化に関与する
著者名:大森優子、小野裕介、森川孝則、元井冬彦、樋口亮太、山本雅一、早川祐子、唐崎秀則、水上裕輔、海野倫明、古川徹
掲載誌名:Annals of Surgery
DOI: 10.1097/SLA.0000000000004842
PDFはこちら>>


