ピックアップ
2025年01月27日【プレスリリース】実験動物研究所
肝臓ゾネーションが全身糖代謝と体組成を制御する新しい臓器間ネットワーク機構を解明
ー糖尿病と肥満に向けた新しいアプローチへの期待ー
ー糖尿病と肥満に向けた新しいアプローチへの期待ー
■概要
2025年1月25日(土)、帝京大学医学部内科学講座准教授 宇野健司らの研究グループが、東北大学大学院医学系研究科糖尿病代謝・内分泌内科学分野教授 片桐秀樹と東京女子医科大学実験動物研究所教授 本田浩章と連携し、動物モデル(遺伝子改変モデルマウス)を用いて、肝臓に端を発した、全身糖代謝と体組成を制御する新しい臓器間ネットワーク機構の存在とその仕組みを明らかにしました。肝臓は、肝細胞や動静脈、門脈、胆管などによって構築される無数の肝小葉構造が集まってできています。様々な栄養素の代謝(metabolism)は、肝小葉内の領域ごと(門脈域、中心静脈域、中間域)に分かれて(zonation)調節されており、このことは代謝の肝臓ゾネーション(metabolic liver zonation※1)と呼ばれています。しかし、これまで肝臓ゾネーションの詳細なメカニズムは明らかではありませんでした。
そこで、本研究では、この肝臓ゾネーションが生体内で時空間的にどのように調節され、全身の代謝や脂肪組織・骨格筋などの他臓器へいかなる影響を及ぼすのか、その機序を解明することとしました。具体的には、肝臓ゾネーションに関与するR-spondin3(Rspo3)(※2)蛋白を標的とし、モデルマウスを用いた様々な検討を行いました。その結果、生体内には、肝臓のRspo3に由来する新しい臓器間のネットワーク機構が存在することを見出しました。さらに、肝臓がこのネットワークを介して、脳や筋肉、脂肪組織と連携することにより、全身の糖代謝を制御する、また褐色脂肪組織や白色脂肪組織由来のエネルギー消費のバランスを制御するという、新たな知見を得ました。
■研究の背景
哺乳動物の生命機能、特に代謝恒常性は分泌生理活性物質、神経系や血管系ネットワークを介して体内各臓器が連携することで維持されています。飽食の現代、肥満を背景にこの恒常性維持機構が破綻し、糖尿病・メタボリックシンドロームの病態に繋がることが大きな問題となっています。
これまで、本研究代表者の宇野准教授は、肝臓での脂肪やアミノ酸代謝に基づく情報が、自律神経ネットワークを介して各臓器、ひいては全身の代謝を協調的に調節するという、臓器間・栄養素間代謝連携機構が存在することを世界に先駆けて発見してきました。この機構は、肝臓を起点とし求心性(迷走)神経→脳→遠心性(交感)神経からなる神経ネットワークにより構築され、全身の代謝恒常性維持という生理機能を有する反面、過栄養が持続するとかえってメタボリックシンドロームの諸病態の進展に繋がる病態生理をも有することが分かってきました。これらはまさに、多様さ・複雑さを持って機能する生命原理が体内には存在していること、その一端を示していると言えます。
これらの知見を踏まえると、体内にはいまだ未知の臓器間ネットワーク機構が数多く存在していることが想定され、新たな臓器連携の仕組みを解き明かすことは非常に大切であります。
これまで、本研究代表者の宇野准教授は、肝臓での脂肪やアミノ酸代謝に基づく情報が、自律神経ネットワークを介して各臓器、ひいては全身の代謝を協調的に調節するという、臓器間・栄養素間代謝連携機構が存在することを世界に先駆けて発見してきました。この機構は、肝臓を起点とし求心性(迷走)神経→脳→遠心性(交感)神経からなる神経ネットワークにより構築され、全身の代謝恒常性維持という生理機能を有する反面、過栄養が持続するとかえってメタボリックシンドロームの諸病態の進展に繋がる病態生理をも有することが分かってきました。これらはまさに、多様さ・複雑さを持って機能する生命原理が体内には存在していること、その一端を示していると言えます。
これらの知見を踏まえると、体内にはいまだ未知の臓器間ネットワーク機構が数多く存在していることが想定され、新たな臓器連携の仕組みを解き明かすことは非常に大切であります。
■研究の成果
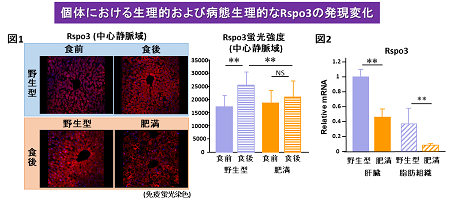
今回の研究では、まずは、肝臓において、Rspo3の生理的な発現様式をmRNAレベル、蛋白レベルで検討しました。Rspo3は、やせ型では食事摂食後に中心静脈域に収束する特徴を持つのに対し、肥満型ではこうした発現様式が減弱している(図1)とともに、Rspo3の発現自体が減少していること(図2)が分かりました。すなわち、肝臓においてRspo3の時空間的な調節は、肥満の病態では変調を来してしまい、肝臓の代謝に大きな影響をもたらすことが考えられました。
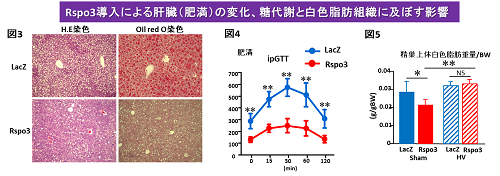
そこで、肥満モデルマウスの肝臓にウイルスを用いてRspo3を導入すると、脂肪肝の改善(図3)のみならず、糖尿病の改善(図4)と肝臓・脂肪組織・骨格筋インスリン抵抗性の改善が見られました。また、遠隔臓器への特徴的な影響として、白色脂肪組織では脂肪細胞の縮小化(図5)とエネルギー消費に関わるUcp1(※3)の発現増加を認めましたが、逆に褐色脂肪組織では脂肪細胞の増大化とUcp1の発現低下を認めました。肥満の状態では、褐色脂肪組織でのエネルギー消費が亢進することで、さらなる肥満が進行しないようにする防御機構が働きます。今回の結果は、過剰な刺激を受ける褐色脂肪組織を休ませ、新たに白色・褐色脂肪組織でのエネルギー消費の配分を再調節することで、体内の恒常性を保つように働いていることを示していると考えられます。そして、この肝臓から白色脂肪組織の縮小化という臓器をまたいだ遠隔作用は、肝臓と脳を繋ぐ迷走神経肝臓枝を切断(Hepatic vagotomy:HV)することで見られなくなり(図5)、これはまさに肝臓由来の迷走神経を介した新しい臓器間神経ネットワーク機構が体内に存在していることを示しております。
■特記事項
本研究は、科学研究費助成事業(科研費18H02858, 22H03130, 23K24389)、持田記念医学薬学振興財団、大和証券ヘルス財団、テルモ生命科学振興財団、武田科学振興財団および小柳財団の助成により行われました。
本研究成果は2025年1月24日(金)14時(米国東部時間)に国際オンライン科学誌「PLOS Biology」に掲載されました。
・タイトル:Rspo3-mediated metabolic liver zonation regulates systemic glucose metabolism and body mass in mice
・著者:Kenji Uno (Corresponding author), Takuya Uchino, Takashi Suzuki, Yohei Sayama, Naoki Edo, Kiyoko Uno-Eder, Koji Morita, Toshio Ishikawa, Miho Koizumi, Hiroaki Honda, Hideki Katagiri, Kazuhisa Tsukamoto
・DOI:10.1371/journal.pbio.3002955
・URL:https://journals.plos.org/plosbiology/article?id=10.1371/journal.pbio.3002955
■用語説明
※1 Metabolic liver zonation(代謝の肝臓ゾネーション)
肝臓は、特徴的な肝小葉構造から成り、小葉内では肝細胞は中心静脈を中心に放射状に配し、辺縁には門脈・動脈・胆管、その間を類洞が繋いでいます。消化管から摂取された栄養素は、肝小葉内では門脈域から類洞を通り中心静脈域に流れることから、中心静脈域や門脈域の領域に応じて糖・脂質・アミノ酸代謝の比重が異なるという時間的なMetabolic zonation(代謝の領域局在性)が存在しています。また、肝臓内門脈域の肝細胞では糖新生・脂肪酸酸化・尿素合成の代謝、中心静脈域の肝細胞では解糖・脂肪酸合成・グルタミン合成の代謝の比重が多いとされ、肝臓内における栄養素代謝には空間的なMetabolic zonationがあるとされます。
※2 R-spondin3(Rspo3)
Rspo3は全身の各臓器、特に肝臓での発現が多いとされ、Wntとその下流b-catenin経路を介して、肝臓ゾネーションに関わるとされています。
※3 Ucp1(Uncoupling protein 1:脱共役蛋白質1)
Ucp1は脂肪細胞のミトコンドリア内膜に局在するタンパク質で、ミトコンドリア膜間のプロトン勾配を利用した熱産生の機能を担っており、エネルギー消費を促進します。
今回の研究では、まずは、肝臓において、Rspo3の生理的な発現様式をmRNAレベル、蛋白レベルで検討しました。Rspo3は、やせ型では食事摂食後に中心静脈域に収束する特徴を持つのに対し、肥満型ではこうした発現様式が減弱している(図1)とともに、Rspo3の発現自体が減少していること(図2)が分かりました。すなわち、肝臓においてRspo3の時空間的な調節は、肥満の病態では変調を来してしまい、肝臓の代謝に大きな影響をもたらすことが考えられました。

そこで、肥満モデルマウスの肝臓にウイルスを用いてRspo3を導入すると、脂肪肝の改善(図3)のみならず、糖尿病の改善(図4)と肝臓・脂肪組織・骨格筋インスリン抵抗性の改善が見られました。また、遠隔臓器への特徴的な影響として、白色脂肪組織では脂肪細胞の縮小化(図5)とエネルギー消費に関わるUcp1(※3)の発現増加を認めましたが、逆に褐色脂肪組織では脂肪細胞の増大化とUcp1の発現低下を認めました。肥満の状態では、褐色脂肪組織でのエネルギー消費が亢進することで、さらなる肥満が進行しないようにする防御機構が働きます。今回の結果は、過剰な刺激を受ける褐色脂肪組織を休ませ、新たに白色・褐色脂肪組織でのエネルギー消費の配分を再調節することで、体内の恒常性を保つように働いていることを示していると考えられます。そして、この肝臓から白色脂肪組織の縮小化という臓器をまたいだ遠隔作用は、肝臓と脳を繋ぐ迷走神経肝臓枝を切断(Hepatic vagotomy:HV)することで見られなくなり(図5)、これはまさに肝臓由来の迷走神経を介した新しい臓器間神経ネットワーク機構が体内に存在していることを示しております。

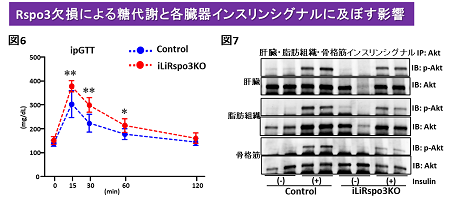
次に、肝臓特異的にRspo3を欠損したモデルマウスでは、過剰発現モデルとは逆に、脂肪肝の進展と糖代謝の増悪(図6)、肝臓・脂肪組織・骨格筋インスリンシグナル減弱(図7)など、いわゆる糖尿病・メタボリックシンドロームの病態へ進展していることが認められました。

■研究の成果の意義
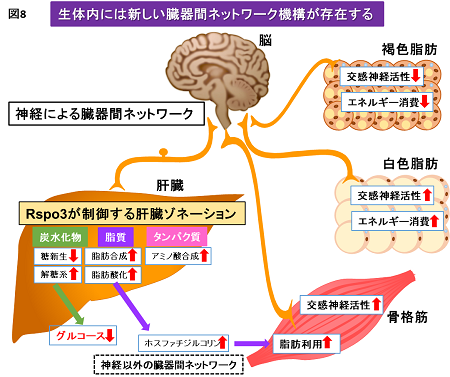
Rspo3を介した肝臓ゾネーションの調節は、新しい臓器間ネットワークを構築し、全身の糖代謝と脂肪組織・骨格筋の質の制御を行うという生命現象が明らかになりました(図8)。そして、Rspo3を用いて、肥満で変調した肝臓ゾネーションに再構築のスイッチを入れることが、臓器連携を介して糖尿病の改善、白色・褐色脂肪組織のエネルギー消費の再配分や、骨格筋の質向上という、全身の代謝恒常性の回復に繋がる可能性を示唆していました。
糖尿病やメタボリックシンドローム、サルコペニアの患者が増加する高齢化の本邦において、今回の研究で解明した肝臓ゾネーション由来の臓器間ネットワーク機構を選択的に制御することができれば、こうした疾患に対して有意義な治療応用への可能性を秘めていると期待されます。
Rspo3を介した肝臓ゾネーションの調節は、新しい臓器間ネットワークを構築し、全身の糖代謝と脂肪組織・骨格筋の質の制御を行うという生命現象が明らかになりました(図8)。そして、Rspo3を用いて、肥満で変調した肝臓ゾネーションに再構築のスイッチを入れることが、臓器連携を介して糖尿病の改善、白色・褐色脂肪組織のエネルギー消費の再配分や、骨格筋の質向上という、全身の代謝恒常性の回復に繋がる可能性を示唆していました。
糖尿病やメタボリックシンドローム、サルコペニアの患者が増加する高齢化の本邦において、今回の研究で解明した肝臓ゾネーション由来の臓器間ネットワーク機構を選択的に制御することができれば、こうした疾患に対して有意義な治療応用への可能性を秘めていると期待されます。

■特記事項
本研究は、科学研究費助成事業(科研費18H02858, 22H03130, 23K24389)、持田記念医学薬学振興財団、大和証券ヘルス財団、テルモ生命科学振興財団、武田科学振興財団および小柳財団の助成により行われました。
本研究成果は2025年1月24日(金)14時(米国東部時間)に国際オンライン科学誌「PLOS Biology」に掲載されました。
・タイトル:Rspo3-mediated metabolic liver zonation regulates systemic glucose metabolism and body mass in mice
・著者:Kenji Uno (Corresponding author), Takuya Uchino, Takashi Suzuki, Yohei Sayama, Naoki Edo, Kiyoko Uno-Eder, Koji Morita, Toshio Ishikawa, Miho Koizumi, Hiroaki Honda, Hideki Katagiri, Kazuhisa Tsukamoto
・DOI:10.1371/journal.pbio.3002955
・URL:https://journals.plos.org/plosbiology/article?id=10.1371/journal.pbio.3002955
■用語説明
※1 Metabolic liver zonation(代謝の肝臓ゾネーション)
肝臓は、特徴的な肝小葉構造から成り、小葉内では肝細胞は中心静脈を中心に放射状に配し、辺縁には門脈・動脈・胆管、その間を類洞が繋いでいます。消化管から摂取された栄養素は、肝小葉内では門脈域から類洞を通り中心静脈域に流れることから、中心静脈域や門脈域の領域に応じて糖・脂質・アミノ酸代謝の比重が異なるという時間的なMetabolic zonation(代謝の領域局在性)が存在しています。また、肝臓内門脈域の肝細胞では糖新生・脂肪酸酸化・尿素合成の代謝、中心静脈域の肝細胞では解糖・脂肪酸合成・グルタミン合成の代謝の比重が多いとされ、肝臓内における栄養素代謝には空間的なMetabolic zonationがあるとされます。
※2 R-spondin3(Rspo3)
Rspo3は全身の各臓器、特に肝臓での発現が多いとされ、Wntとその下流b-catenin経路を介して、肝臓ゾネーションに関わるとされています。
※3 Ucp1(Uncoupling protein 1:脱共役蛋白質1)
Ucp1は脂肪細胞のミトコンドリア内膜に局在するタンパク質で、ミトコンドリア膜間のプロトン勾配を利用した熱産生の機能を担っており、エネルギー消費を促進します。
| 【本件に関する問い合わせ先】 <研究に関すること> 帝京大学医学部内科学講座 宇野 健司 TEL :03-3964-1211 E-mail :unok@med.teikyo-u.ac.jp <報道に関すること> 帝京大学本部広報課 TEL :03-3964-4162 E-mail :kouhou@teikyo-u.ac.jp 東北大学大学院医学系研究科・医学部広報室 東北大学病院広報室 TEL :022-717-8032 E-mail :press.med@grp.tohoku.ac.jp 東京女子医科大学広報室 TEL :03-3353-8111 E-mail :kouhou.bm@twmu.ac.jp |


