ピックアップ
2021年04月06日研究成果顕微解剖形態形成分野
Prolonged maintenance of hematopoietic stem cells
that escape from Thrombopoietin deprivation
トロンボポエチン欠損下における造血幹細胞維持現象とその機構の解明
that escape from Thrombopoietin deprivation
トロンボポエチン欠損下における造血幹細胞維持現象とその機構の解明
学校法人 東京女子医科大学
シンガポール国立大学がん科学研究所
熊本大学国際先端医学研究機構
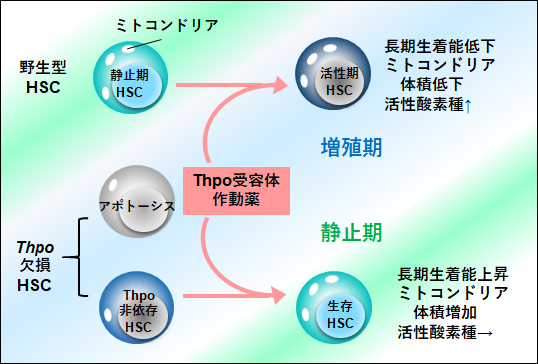
| Point ●サイトカインのThrombopoietin(Thpo)は成人期の造血幹細胞の維持に不可欠であるが、Thpoに依存せずに生存、維持される造血幹細胞の存在とその機構を解析した。 ●Thpo 欠損は造血幹細胞の静止期性の低下、細胞周期進行の障害、ミトコンドリア機能障害及びアポトーシス亢進を引き起こす。 ●Thpo遺伝子欠損マウスにおけるThpo受容体作動薬を連続投与したところ、造血幹細胞の数の増幅とともに静止性の誘導が見られた。 ●造血幹細胞は機能やマーカーの多様性が知られているが、Thpo欠損下でも生存できる造血幹細胞のサブグループがあることが示唆された。 |
Ⅰ 研究の背景と経緯
一生涯にわたる恒常的な血球産生には造血幹細胞 (hematopoietic stem cell: HSC) の維持・増殖・分化が不可欠である。しかしながら、HSCの維持・増殖・分化がどの様に制御されているのかいまだその全容は解明されていない。成人期HSCはストレス造血時などに備え、自己複製能を保持し細胞周期静止期状態で維持されている。一個体において、一つのHSCは最小限の増殖回数しか経験せず、特にミトコンドリア代謝活性を抑制し低酸素下で解糖系代謝に依存することが、HSCの少ない増殖回数、静止期性の維持に関連するものと考えられている。一方、HSCに直接作用し、その静止期、分化などの機能を調整する数少ないサイトカインの一つにThrombopoietin (Thpo) がある。ThpoはHSCの静止期を維持するとともに、自己複製増殖も活性化する一見矛盾した作用機構が報告されている。本論文ではThpoによるHSC静止期誘導とミトコンドリア活性に焦点をあて、新規のHSC維持機構とThpo 受容体作動薬の作用機構を新たに報告した。
Ⅱ 研究の内容
Thpoは巨核球・血小板産生のみならず、HSCの自己複製増殖を引き起こすことが知られている[1]。一方、成人期のThpo遺伝子欠損マウスやThpo受容体であるMpl遺伝子欠損マウスにおいて、Thpoシグナルの活性化はHSCの静止性の維持と同時に自己複製の促進を行うことも報告されている[2][3]。本研究では独自で開発したThpo遺伝子欠損マウスの成人期骨髄HSCは、過去の報告と同様、HSC静止期の減少がみとめられたが、細胞周期の詳細な解析により、Thpo遺伝子欠損マウス由来HSCではSubG1期の頻度の有意な上昇がみられ、Annexin V染色性の上昇もみられたため、アポトーシス誘導が促進することを確認した。また、Thpo作動薬のRomiplostimをThpo遺伝子欠損マウス及び、野生型マウスに連日投与したところ、野生型マウスではRomiplostim投与とともに増殖期HSCのみの増加が認められたが、Thpo遺伝子欠損マウスでは、増殖期ではなく静止期にあるHSC数の増加がみられた。さらには遺伝子発現解析や種々の代謝解析を行ったところ、Thpo欠損HSCはミトコンドリア代謝、オートファジー、タンパク産生など広く代謝に関わる変動が認められ、静止性を獲得する際にこれらの正常化が認められることを確認した。これらの結果は、HSCの静止性の維持にはThpoによる代謝調整が重要であり、また、Thpo非依存性に生存し、Thpoシグナルに異なった反応性を示すHSCが骨髄内に存在することを示唆していた。
Ⅲ 今後の展開
近年、HSCは遺伝子発現、タンパク発現などにおいて多様性(heterogeneity)を有し、分化・増殖・維持機能も異なった集団からできていると考えられている。本研究では、Thpo反応性においてのHSC Heterogeneityを明確にし、Thpo反応性がHSCの静止状態の維持とそれにかかわる代謝状態を制御することを明確にし報告した。治療目的のために生体外でのHSC培養、維持法は検証されているものの、幹細胞能の高いHSCを生体内外で維持する方法は確立されていない。本研究をさらに発展させ、治療応用を目的とした生体内外のHSC増幅と維持の新規方法を開拓し、効率化を目指していきたいと考えている。また、Thpo作動薬の使用は既存治療で効果不十分な再生不良性貧血患者の適応として認可されており、今後、HSCのThpo反応性のさらなる解明は造血疾患の病態解明と治療開発につながると思われる。
文献
1 Kovtonyuk, L. v et al. (2016) Enhanced thrombopoietin but not G-CSF receptor stimulation induces self-renewing hematopoietic stem cell divisions in vivo. Blood 127, 3175–9
2 Qian, H. et al. (2007) Critical role of thrombopoietin in maintaining adult quiescent hematopoietic stem cells. Cell stem cell 1, 671–84
3 Yoshihara, H. et al. (2007) Thrombopoietin/MPL signaling regulates hematopoietic stem cell quiescence and interaction with the osteoblastic niche. Cell stem cell 1, 685–97
【プレス情報】
1.掲載誌名 Blood
2.論文タイトル Prolonged maintenance of hematopoietic stem cells that escape from Thrombopoietin deprivation
3.論文のオンライン掲載日
2021年3月3日
【本成果を得るに当たり協働した研究者】
Toshio Suda, シンガポール国立大学がん科学研究所, 熊本大学国際先端医学研究機構
PDFはこちら>>
シンガポール大学プレスリリースページ>> Facebook l LinkedIn l Twitter


