お知らせ
2023年08月08日 【プレスリリース】造血幹細胞活性を制御する新規分子の同定に成功、造血幹細胞移植や再生医療に新たな知見
造血幹細胞活性を制御する新規分子の同定に成功、
造血幹細胞移植や再生医療に新たな知見
造血幹細胞移植や再生医療に新たな知見
東京女子医科大学実験動物研究所の本田浩章教授(同研究所所長)らのグループは、国立国際医療研究センター研究所の田久保圭誉プロジェクト長らのグループ、シンガポール大学の須田年生教授らの研究グループ、椙山女学園大学の本山昇教授らの研究グループ、その他の研究グループと共同で、造血幹細胞活性を制御する新規分子を同定しました。本研究成果は米国科学アカデミー発行の機関誌である「Proceedings of the National Academy of Sciences(Proc. Natl. Acad. Sci. USA, PNAS)」の8月8日号に掲載されます。
| Point
・造血幹細胞は自己複製を行うと共に血液の様々な系統に分化し、生涯にわたって造血系を維持します。造血幹細胞活性がどの様な機序により制御されているかについて、これまで様々な研究が行われてきましたが、その全貌は明らかではありません。
・我々は以前に、造血幹細胞で高い発現を認めるエピジェネティック因子であるMBTD1/HEMP(mbt domain containing 1/hematopoietic expressed mammalian polycomb)を先天性に欠失したマウスを作製し、MBTD1は胎生期の造血幹細胞活性に重要な役割を果たしていることを見出しました(Honda H et al., Proc Natl Acad Sci USA 108, 2468-2473, 2011)。しかし、このマウスはKlippel-Feil症候群に類似した骨形成不全により生後すぐに死亡するため、成体の造血幹細胞におけるMBTD1の機能は明らかではありませんでした。 ・今回我々は成体で誘導可能にMBTD1を欠失したマウスを作製しました。造血系の解析により、MBTD1は転写因子FOXO3aを介して細胞周期を調節すると共に、様々な分子との相互作用によりエネルギー代謝を調節することにより、造血幹細胞活性を制御していることを見出しました。我々の研究結果は、造血幹細胞活性の制御機構に新たな知見をもたらしたと考えられます。 |
Ⅰ 研究の背景と経緯
図1
.png) 造血幹細胞は骨髄に存在し、自己複製を行うと共に赤血球、白血球、血小板などの系列の細胞に分化し、成体での造血を維持します(図1)。造血系においては、造血幹細胞は細胞の表面マーカーの組み合わせにより定義され単離することが可能で、単離された造血幹細胞は白血病や骨髄異形成症候群などの造血器腫瘍に対する骨髄移植療法に使用されています。しかし、造血幹細胞活性がどの様な機序により維持されているかについては、これまで様々な研究が行われていますが全体像は明らかにされていません。
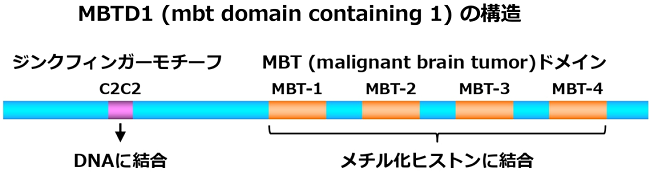
造血幹細胞は骨髄に存在し、自己複製を行うと共に赤血球、白血球、血小板などの系列の細胞に分化し、成体での造血を維持します(図1)。造血系においては、造血幹細胞は細胞の表面マーカーの組み合わせにより定義され単離することが可能で、単離された造血幹細胞は白血病や骨髄異形成症候群などの造血器腫瘍に対する骨髄移植療法に使用されています。しかし、造血幹細胞活性がどの様な機序により維持されているかについては、これまで様々な研究が行われていますが全体像は明らかにされていません。我々は、マウスの造血幹細胞で同定された、MBTD1/HEMP(mbt domain containing 1/hematopoietic expressed mammalian polycomb)という分子に注目しました。この分子は、DNAに結合するC2C2ジンクフィンガーモチーフとメチル化されたヒストンに結合するMBT(malignant brain tumor)ドメインを4つを有しており、おそらくエピジェネティックな制御システム(DNAの配列変化によらず遺伝子発現を制御するシステム)により遺伝子発現を調節していると想定されます(図2)。我々は以前に、先天性にMBTD1を欠失したマウスを作製し、MBTD1は胎生期の造血幹細胞活性に重要な役割を果たしていることを見出しました (Honda H et al., Proc Natl Acad Sci USA 108, 2468-2473, 2011)。しかし、このマウスはKlippel-Feil症候群に類似した骨形成不全により生後すぐに死亡するため、MBTD1の成体造血における機能は明らかではありませんでした。この問題を解決する目的で、我々は後天性に誘導可能にMBTD1を欠失するマウスを作製し、造血系の解析を行いました。
図2
Ⅱ 研究の内容
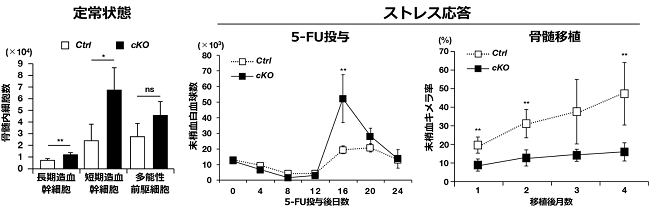
造血系の解析の結果、MBTD1欠失マウス(以下コンディショナルノックアウト(cKO)マウス)は正常マウス(以下コントロール(Ctrl)マウス)に比較して、定常時では骨髄における長期骨髄幹細胞、短期骨髄幹細胞、多能性前駆細胞など造血幹細胞〜前駆細胞の割合が多く(図3左)、5-Fluorouracil(5-FU)投与や骨髄移植などのストレス応答では造血幹細胞が異常な挙動(5-FU投与では過剰な増殖(16日)、骨髄移植では末梢血キメラ率の低下(1~4ヶ月))を示すことが明らかになりました(図3右)。
図3
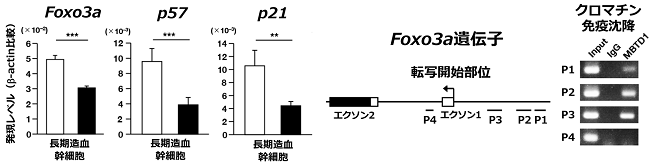
その原因を検索する目的で、CtrlマウスとcKOマウスから長期造血幹細胞を単離し網羅的な遺伝子発現解析を行ったところ、cKOマウスの造血幹細胞では、サイクリン依存性キナーゼ阻害因子(cyclin-dependent kinase inhibitor, CDKI)を介して造血幹細胞を静止状態に留める転写因子であるFOXO3aの発現が低下しており、実際その下流のCKDIであるp57とp21の発現低下も認められ(図4左)、造血幹細胞が静止期に止まらず過剰に細胞周期に突入していることが明らかとなりました。また、クロマチン免疫沈降により、MBTD1はFOXO3a遺伝子のプロモーター領域に直接に結合していることも判明しました(図4右)。
図4
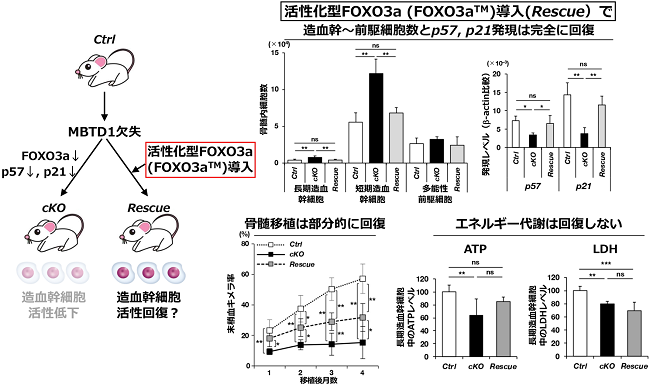
我々は次に、cKOマウス造血幹細胞に認められた異常について、活性化型FOXO3aを導入することによりその表現型が回復するかどうかについて検討を行いました。この目的のために、誘導可能に活性化型FOXO3aであるFoxO3aTMを発現するFoxO3aTMマウスをcKOマウスに掛け合わせ、MBTD1欠失とFoxO3aTMの発現を同時に誘導し、造血系の解析を行いました(以下、cKOマウスにFoxO3aTMマウスを掛け合わせたマウスをレスキュー(Rescue)マウスと呼びます)(図5左)。解析の結果、Rescueマウスの造血幹細胞では、cKOマウスの造血幹細胞で認められた造血幹細胞〜前駆細胞の増加やCDKIの発現低下による過剰な細胞周期突入は完全に回復しましたが(図5右上)、骨髄移植における末梢血キメラ率の低下は部分的にしか回復しませんでした(図5右下左)。造血幹細胞は、細胞周期のみならず、細胞内のエネルギー代謝によりその活性が調節されていることが示されています。そこで、長期造血幹細胞におけるATP濃度と造血幹細胞がおかれている低酸素状態で主にエネルギー代謝を司る解糖系の活性化の指標であるLDH活性を測定したところ、Ctrlマウスに比較してcKOマウスでは有意に低下していましたが、これらはFoxO3aTMを導入したRescueマウスでは回復しないことが明らかとなりました(図5右下右)。
図5
この原因を検索する目的で、造血幹前駆細胞の細胞株として用いられているEML細胞を用いて、MBTD1と結合する分子の同定を行いました。その結果、これまでMBTD1と相互作用をするとして報告されているヒストンアセチル化を制御するTIP60複合体の分子であるEP400, EPC1, TRPPAP, MRGBP, RUVBL1, RUVBL2が同定され、それらに加えて新たにリボゾーム蛋白質であるRPL17, RPL18, RPS19、ヒートショック蛋白質であるHSPA9、カルシウム結合蛋白質であるCalmodulin、およびmRNA結合蛋白質であるDDX6が同定されました。RPL17, RPL18, RPS19, HSPA9, Calmodulinはこれまでに造血幹細胞を含めた幹細胞活性に重要であることが報告されており、MBTD1はこれらに加えてDDX6と相互作用することにより造血幹細胞の細胞内代謝を調節している可能性が示唆されました(図6左)。また結合分子として同定された蛋白質は、TIP60複合体のみならず、Heat shock proteins, mRNA regulators, Ribosomal proteins, Calmodulinなど様々な機能体として相互作用をしていることが明らかとなりました(図6右)。
図6
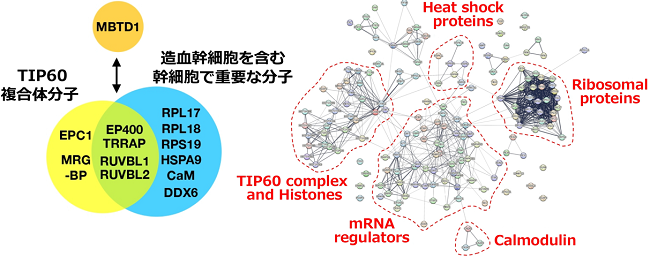
図7
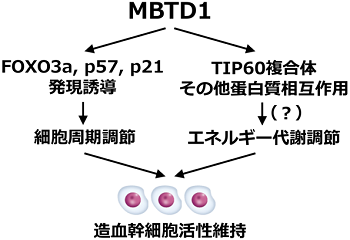
以上の結果から、MBTD1はFOXO3a-CDKI(p57, p21)の発現誘導を介した細胞周期調節と、おそらくTIP60複合体やその他の蛋白質との相互作用によりエネルギー代謝調節の両面を調節することにより、造血幹細胞活性を制御していると想定されました(図7)。
Ⅲ 今後の展開
我々は、先天性および後天性にMBTD1を欠失したマウスを作製することにより、MBTD1は胎生期のみならず成体でも造血幹細胞活性に重要であることを示しました。さらに、成体ではFOXO3aを介した細胞周期とFOXO3aを介さないエネルギー代謝の両面を調節することにより造血幹細胞活性を制御していることを明らかにしました。FOXO3aは造血幹細胞を含めた幹細胞の細胞周期調節には非常に重要な分子であり、その発現を直接制御する分子が見つかったのは今回のMBTD1が初めてです。
今後は、MBTD1がどの様な機序で目的遺伝子や蛋白質に結合しその機能を発揮するのか、それらがこれまで示されている他の造血幹細胞維持機構と協調して、造血幹細胞活性を制御していくか、他の組織幹細胞においてMBTD1はどの様な役割を担っているのか、などを明らかにすることが重要と考えられます。得られた知見は造血幹細胞移植や再生医療に役立つと想定されます。
【用語説明】
・エピジェネティクス:DNAやヒストンに対してメチル化などの化学修飾を行うことにより、塩基配列の変化を伴わずに遺伝子発現が制御される仕組み
・5-Fluorouracil(5-FU)投与:抗癌剤である5-FUを投与することにより骨髄抑制を誘導し、静止期の状態にある造血幹細胞を分裂期に導入させる
・末梢血キメラ率:末梢血中のドナー由来の細胞の割合
・サイクリン依存性キナーゼ阻害因子:細胞周期の進行に必要なサイクリン・サイクリン依存性キナーゼの働きを阻害することにより、細胞周期を負に制御する
・クロマチン免疫沈降:蛋白質とDNAの相互作用(結合)を調べる手法で、目的蛋白質に対する抗体を用いて蛋白質・DNA複合体の免疫沈降を行い、DNAのどの領域が含まれているかを解析する
・プロモーター:転写因子複合体が結合し、転写が開始されるDNA上の部位
【お問い合わせ先】
<研究に関すること>
東京女子医科大学実験動物研究所・所長、先端生命医科学専攻疾患モデル研究分野・教授
本田 浩章(ホンダ ヒロアキ)
〒162-8666 東京都新宿区河田町8-1
Tel: 03-3353-8112 内線 42451
Fax: 03-5269-7423
E-mail: honda.hiroaki@twmu.ac.jp
国立国際医療センター研究所、生体恒常性プロジェクト・プロジェクト長
田久保 圭誉(タクボ ケイヨ)
〒162-0052 東京都新宿区戸山1-21-1
Tel: 03-3202-7181 内線 2875
E-mail: ktakubo@ri.ncgm.go.jp
<報道取材に関すること>
東京女子医科大学 広報室
〒162-8666 東京都新宿区河田町8-1
Tel:03-3353-8111 Fax:03-3353-6793
E-mail: kouhou.bm@twmu.ac.jp
国立国際医療研究センター 企画戦略局 広報企画室
〒162-8655 東京都新宿区戸山1-21-1
Tel: 03-3202-7181
E-mail: press@hosp.ncgm.go.jp
【プレス情報】
1.掲載誌名:Proceedings of the National Academy of Sciences(Proc. Natl. Acad. Sci. USA, PNAS)
2.論文タイトル:MBTD1 preserves adult hematopoietic stem cell pool size and function
3.著者名:Keiyo Takubo*1, Phyo Wai Htun, Takeshi Ueda, Yasuyuki Sera2, Masayuki Iwasaki2, Miho Koizumi2, Kohei Shiroshita1, Hiroshi Kobayashi1, Miho Haraguchi1, Shintaro Watanuki1, Zen-ichiro Honda, Norimasa Yamasaki, Ayako Nakamura-Ishizu2, Fumio Arai, Noboru Motoyama3, Tomohisa Hatta, Tohru Natsume, Toshio Suda4, Hiroaki Honda*2
(*は責任著者、1:国立国際医療研究センター、2:東京女子医科大学、3:椙山女学園大学、4:シンガポール国立大学)
4.掲載号:2023年8月8日号(論文のオンライン掲載日7月31日15時(米国西部時間))
5.DOI number: 10.1073/pnas.2206860120
6.URL: https://doi.org/10.1073/pnas.2206860120
【本成果を得るにあたりご協力いただいた大学、援助をいただいた研究費・助成金】
本研究成果は、東京女子医科大学、国立国際医療研究センター研究所、シンガポール国立大学、産業技術総合研究所、近畿大学、広島大学、お茶の水女子大学、九州大学、椙山女学園大学、ミャンマー連邦共和国Healthcare Call Centerの共同研究によるものです。本研究は、Human Frontier Science Program Organization Long-Term Fellowship、AMED-CREST (JP22gm1310006, JP20gm1210011)、国際医療研究開発費、文部科学省科学研究費補助金(21H02957, 22K19550)の助成を得て進められました。
我々は、先天性および後天性にMBTD1を欠失したマウスを作製することにより、MBTD1は胎生期のみならず成体でも造血幹細胞活性に重要であることを示しました。さらに、成体ではFOXO3aを介した細胞周期とFOXO3aを介さないエネルギー代謝の両面を調節することにより造血幹細胞活性を制御していることを明らかにしました。FOXO3aは造血幹細胞を含めた幹細胞の細胞周期調節には非常に重要な分子であり、その発現を直接制御する分子が見つかったのは今回のMBTD1が初めてです。
今後は、MBTD1がどの様な機序で目的遺伝子や蛋白質に結合しその機能を発揮するのか、それらがこれまで示されている他の造血幹細胞維持機構と協調して、造血幹細胞活性を制御していくか、他の組織幹細胞においてMBTD1はどの様な役割を担っているのか、などを明らかにすることが重要と考えられます。得られた知見は造血幹細胞移植や再生医療に役立つと想定されます。
【用語説明】
・エピジェネティクス:DNAやヒストンに対してメチル化などの化学修飾を行うことにより、塩基配列の変化を伴わずに遺伝子発現が制御される仕組み
・5-Fluorouracil(5-FU)投与:抗癌剤である5-FUを投与することにより骨髄抑制を誘導し、静止期の状態にある造血幹細胞を分裂期に導入させる
・末梢血キメラ率:末梢血中のドナー由来の細胞の割合
・サイクリン依存性キナーゼ阻害因子:細胞周期の進行に必要なサイクリン・サイクリン依存性キナーゼの働きを阻害することにより、細胞周期を負に制御する
・クロマチン免疫沈降:蛋白質とDNAの相互作用(結合)を調べる手法で、目的蛋白質に対する抗体を用いて蛋白質・DNA複合体の免疫沈降を行い、DNAのどの領域が含まれているかを解析する
・プロモーター:転写因子複合体が結合し、転写が開始されるDNA上の部位
【お問い合わせ先】
<研究に関すること>
東京女子医科大学実験動物研究所・所長、先端生命医科学専攻疾患モデル研究分野・教授
本田 浩章(ホンダ ヒロアキ)
〒162-8666 東京都新宿区河田町8-1
Tel: 03-3353-8112 内線 42451
Fax: 03-5269-7423
E-mail: honda.hiroaki@twmu.ac.jp
国立国際医療センター研究所、生体恒常性プロジェクト・プロジェクト長
田久保 圭誉(タクボ ケイヨ)
〒162-0052 東京都新宿区戸山1-21-1
Tel: 03-3202-7181 内線 2875
E-mail: ktakubo@ri.ncgm.go.jp
<報道取材に関すること>
東京女子医科大学 広報室
〒162-8666 東京都新宿区河田町8-1
Tel:03-3353-8111 Fax:03-3353-6793
E-mail: kouhou.bm@twmu.ac.jp
国立国際医療研究センター 企画戦略局 広報企画室
〒162-8655 東京都新宿区戸山1-21-1
Tel: 03-3202-7181
E-mail: press@hosp.ncgm.go.jp
【プレス情報】
1.掲載誌名:Proceedings of the National Academy of Sciences(Proc. Natl. Acad. Sci. USA, PNAS)
2.論文タイトル:MBTD1 preserves adult hematopoietic stem cell pool size and function
3.著者名:Keiyo Takubo*1, Phyo Wai Htun, Takeshi Ueda, Yasuyuki Sera2, Masayuki Iwasaki2, Miho Koizumi2, Kohei Shiroshita1, Hiroshi Kobayashi1, Miho Haraguchi1, Shintaro Watanuki1, Zen-ichiro Honda, Norimasa Yamasaki, Ayako Nakamura-Ishizu2, Fumio Arai, Noboru Motoyama3, Tomohisa Hatta, Tohru Natsume, Toshio Suda4, Hiroaki Honda*2
(*は責任著者、1:国立国際医療研究センター、2:東京女子医科大学、3:椙山女学園大学、4:シンガポール国立大学)
4.掲載号:2023年8月8日号(論文のオンライン掲載日7月31日15時(米国西部時間))
5.DOI number: 10.1073/pnas.2206860120
6.URL: https://doi.org/10.1073/pnas.2206860120
【本成果を得るにあたりご協力いただいた大学、援助をいただいた研究費・助成金】
本研究成果は、東京女子医科大学、国立国際医療研究センター研究所、シンガポール国立大学、産業技術総合研究所、近畿大学、広島大学、お茶の水女子大学、九州大学、椙山女学園大学、ミャンマー連邦共和国Healthcare Call Centerの共同研究によるものです。本研究は、Human Frontier Science Program Organization Long-Term Fellowship、AMED-CREST (JP22gm1310006, JP20gm1210011)、国際医療研究開発費、文部科学省科学研究費補助金(21H02957, 22K19550)の助成を得て進められました。


