お知らせ
2020年02月12日 【プレスリリース】膀胱がんの新規発症メカニズムの解明 〜新規治療法開発に期待〜
膀胱がんの新規発症メカニズムの解明
〜抗炎症作用を有する薬剤を用いた新規治療法開発に期待〜
〜抗炎症作用を有する薬剤を用いた新規治療法開発に期待〜
学校法人 東京女子医科大学
学校法人 広島大学
Vancouver Prostate Centre
学校法人 広島大学
Vancouver Prostate Centre
| 【ポイント】 ・膀胱がんではKDM6Aという遺伝子の変異が多いことが知られている。我々は膀胱尿路上皮におけるKDM6Aの機能欠失は、がん抑制遺伝子p53の変異と協調して悪性度の高い膀胱がん発症に関与すること、またタバコ由来の発がん物質により筋層浸潤がんに進展することを見いだした。 ・KDM6A機能欠損は膀胱における炎症を誘発し、加えてp53変異は細胞の増殖を誘導することで膀胱がんが発症すること、また発がん物質の投与はさらに炎症を悪化させ、がんの早期進行に関与することを見出した。 ・KDM6A欠失膀胱がんに対して、最も発現が上昇した炎症性分子2種類に対する阻害剤を併用投与すると、炎症が抑えられると共にがんの成長が抑制されることを明らかにした。 |
1.概要
東京女子医科大学・実験動物研究所の本田浩章らのグループは、広島大学泌尿器科学教室の松原昭郎教授らのグループ、カナダVancouver Prostate CentreのDr. Peter C. Blackらのグループ、その他のグループと共同で、膀胱がんの新しい発症メカニズムの解明に成功しました。この結果は、膀胱がんに対する新規治療法開発に役立つと期待されます。
本研究成果は、2020年2月11日10時(米国西部時間)に、米国癌学会American Association for Cancer Research (AACR) 発行の雑誌である、「Clinical Cancer Research」のオンライン版で公開されます。なお、本研究成果の一環として、特許(特願2019-078928)を出願しています。
2.研究の背景と経緯
膀胱がんは、全てのがんの中でも最も再発しやすいがんのひとつとして知られています。また、進行した膀胱がんに対する薬物治療は、まだ選択肢が非常に限られているのが現状です。現在、エピジェネティクス(DNAの配列変化によらず、遺伝子発現を制御するシステム)に関わる遺伝子の異常が、様々ながんに深く関わっていることが知られています。そのうちのひとつKDM6A(別名UTX)は、すべてのがんの中でも膀胱がんで突出して遺伝子変異の頻度が高く、膀胱がんの根幹をなす発症メカニズムに関わっていると考えられます。しかしその詳細な役割については明らかになっていません。
本研究チームはKDM6Aに着目し、膀胱がんにおけるその役割を解明することが、あらたな治療法の開発に繋がると考えました。
3.研究の内容
本研究チームは、膀胱がんの発生母地である尿路上皮特異的に、KDM6Aを欠失させたマウスを作製しました。さらに、ヒト膀胱がんにおいては、KDM6A機能欠失はがん抑制遺伝子であるp53の変異と高頻度に合併するため、KDM6A欠失マウスとp53変異マウスとの掛け合わせを行ない、KDM6A欠失・p53変異の2重マウスを作製しました。
その結果、KDM6A欠失マウスとp53変異マウスには異常は認めませんでしたが、KDM6A欠失・p53変異マウスの2重マウスの膀胱に、尿路上皮の異形成〜上皮内がんを認めました。さらに、これらのマウスにタバコ由来の発がん物質であるN-butyl-N-(4-hydroxybutyl) nitrosamine (BBN) を一定期間投与したところ、2重マウスにのみ筋層にがん細胞が浸潤した進行がん(筋層浸潤がん)を認めました(下図)。
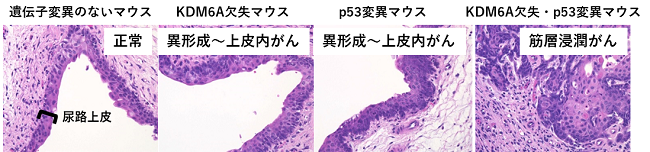
これらのマウスにおける遺伝子発現変化を詳しく調べたところ、KDM6Aが欠失した膀胱では炎症が惹起されており、またp53の異常を有するマウスでは細胞の増殖が促進されており、これらの協調作用により膀胱がんが発症すること、さらにBBNは炎症をより悪化させることで、がんの早期進行に関与することが明らかになりました。
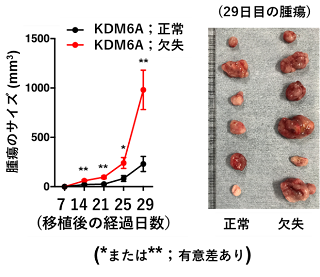
次に、p53遺伝子が変異した膀胱がん細胞株を用意し、KDM6Aを人工的に欠失させた上でマウスに移植しました。するとこの細胞は、KDM6Aが正常である元の膀胱がん細胞と比較して、より大きながんの塊を形成しました。この結果は、KDM6Aの機能欠失が膀胱がんの進行にも関わっていることを明確に示しています (下図A)。
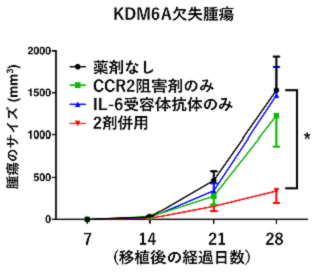
膀胱がんには慢性的な炎症が深く関わっていると考えられています。KDM6A欠失マウスに生じた炎症には、特にIL-6とCCL2とよばれる2つの炎症性蛋白質が関わっていることが判明しました。そこで、これら2つの蛋白質の機能阻害によりKDM6A欠損膀胱がんの成長が抑制されるかどうかを検討する目的で、IL-6の受容体であるIL-6受容体に対する受容体抗体と、CCL2の受容体であるCCR2の阻害剤という2種類の薬剤を用意し、膀胱がん細胞を移植したマウスに投与を行ないました。その結果、2種類の薬剤は単独ではがん細胞の成長を抑制しませんでしたが、併用投与により有意にKDM6A欠損がん細胞の成長を抑制することが明らかになりました(下図B)。
(図A がん細胞の移植後のサイズ推移) (図B 移植後、薬剤投与中のサイズ推移)
 |
 |
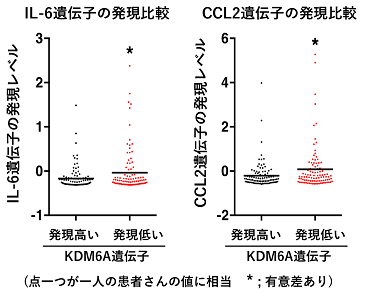
実際に、ヒト臨床検体においても、KDM6A欠失膀胱がんではKDM6Aが正常である膀胱がんに比べてIL-6とCCL2の発現が上昇しており(下図)、炎症の亢進も認められるところから、これらの薬剤の併用療法はヒトKDM6A欠損膀胱がんに対しても抑制効果を示すと期待されます。
膀胱がんは、非常に多様な特徴を持つがん細胞からなる集団であり、そのことが有効な治療薬の開発を拒む一因となっています。また膀胱がんに限らず、新しい治療薬の開発には莫大な費用と時間がかかることから、既存薬を別の病気に対する治療薬として適応拡大させる「ドラッグリポジショニング」が見直されてきています。
本研究チームが用いた2種類の薬剤はいずれも既に市販されており(ヒト化抗IL-6R抗体;一般名トシリズマブ、CCR2阻害剤;一般名プロパゲルマニウム)、またKDM6A変異を有する膀胱がんの患者さんは多いことから、膀胱がんに対する新たな分子標的治療法として有用と考えられ、今後の臨床応用が期待されます。
【お問い合わせ先】
<研究に関すること>
東京女子医科大学 医学部 実験動物研究所 所長・ 教授 本田 浩章(ホンダ ヒロアキ)
〒162-8666 東京都新宿区河田町8-1
Tel&Fax:03-3353-8111 内線22433
E-mail: honda.hiroaki”AT”twmu.ac.jp
<報道担当>
東京女子医科大学 広報室
〒162-8666 東京都新宿区河田町8-1
Tel:03-3353-8111 Fax:03-5269-7326
E-mail : kouhou.bm”AT”twmu.ac.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
【プレス情報】1.掲載誌名 Clinical Cancer Research
2.論文タイトル Kdm6a deficiency activates inflammatory pathways, promotes M2 macrophage polarization, and causes bladder cancer in cooperation with p53 dysfunction.
3.論文のオンライン掲載日と報道解禁日(Embargo) 2020年2月11日10時(米国西部時間)
【本成果を得るにあたりご協力いただいた大学、援助をいただいた研究費・助成金】
本研究成果は、東京女子医科大学、広島大学、Vancouver Prostate Centre、順天堂大学、お茶の水女子大学の共同研究によるものです。本研究は、日本学術振興会(JSPS)の科学研究費(17K11170, 17K16795, 19H03693)、高松宮妃癌研究基金、公益財団法人 テルモ生命科学振興財団研究助成、公益財団法人 花王芸術・科学財団 花王科学奨励賞の助成を得て進められました。
プレスリリースPDFはこちら>>


