お知らせ
2018年10月02日 医師主導治験開始のお知らせ:細胞シートを用いた歯周組織再生療法
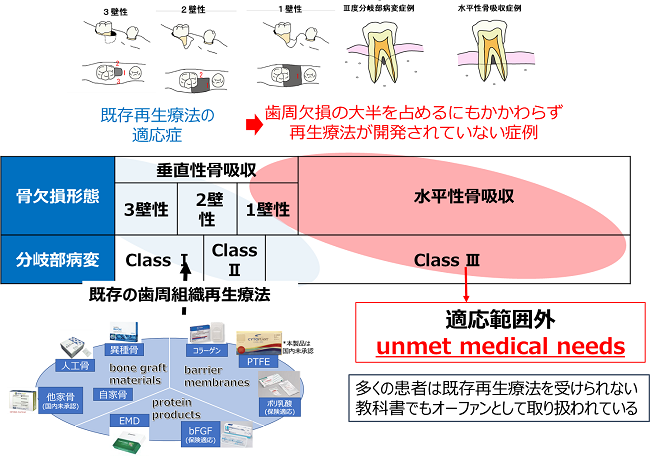
1壁性骨欠損、Ⅲ度分岐部病変もしくは水平性骨吸収のいずれかの歯槽骨欠損を有するポケット深さ4 mm~9 mm の歯周炎を対象としたヒト(同種)歯根膜由来間葉系幹細胞より調製した歯根膜細胞シート(TWP-0001)移植法の 安全性と有効性を検討する探索的臨床試験
・同種(他家)歯根膜由来間葉系幹細胞シートを用いた歯周組織再生療法の医師主導治験を開始いたします。
・用いる細胞は青年抜去歯牙から採取された歯周組織由来間葉系幹細胞であり、その細胞バンクの安全性は医薬品医療機器総合機構にて了承されています。
・既存の治療法では治すことの出来ない重度の歯周炎患者を対象としております。
・東京女子医科大学病院ならびに東京医科歯科大学歯学部附属病院にて合計6症例の移植を実施予定です(対象患者さんの諸条件の詳細は最下部PDFを参照)。
1、概要
東京女子医科大学先端生命医科学研究所・医学部歯科口腔外科学講座の岩田隆紀准教授・安藤智博教授らの研究グループでは、国立研究開発法人日本医療研究開発機構(AMED)・平成30年度再生医療実用化研究事業・企業等の協力を得ながらプロトコールを組む医師主導治験・研究開発課題名「同種歯根膜由来間葉系幹細胞シートによる歯周組織の再建」の支援を受けて、医師主導治験(UMIN000034310)を開始いたします。この治験は、歯槽骨欠損を有する重度歯周炎と診断された患者さんに、ヒトの歯根膜組織に由来する細胞より調製した歯根膜細胞シート(TWP-0001)(以下、治験製品)を移植したときの副作用や効果を検討することを目的としています。
2、背景
本邦では40歳以上の約4割が罹患している歯槽骨の破壊をともなう歯周炎において、これまでに様々な再生療法が開発されてきましたが、広範な欠損においては予知性の高い治療法が存在しないのが現状です。東京女子医科大学先端生命医科学研究所ならびに医学部歯科口腔外科学講座では歯周組織再生担当細胞であると考えられている歯根膜由来間葉系幹細胞に着目し、本学特任教授・名誉教授の岡野光夫先生が発明された細胞シート工学と組み合わせることで歯周組織の再生を目指す細胞治療を開発して参りました。
これまでの研究で、歯周組織の再生には、歯の周囲に存在する軟らかい組織(軟組織)、特に、歯根膜組織に由来する細胞が中心的な役割を果たしていることが明らかになってきました。そして、この歯根膜組織に由来する細胞を人工的に増やして(「培養」といいます)、歯周組織の失われた部分に供給することが歯周組織の再生に有効であることも分かってきました。
また、健康な方から親知らずなどの廃棄される歯をいただき、その歯に付着している組織片から歯根膜組織に由来する細胞を取り出し、セルバンク(必要なときに利用できる小分けされた基になる細胞の集まり)を構築し、移植可能なシート状の構造(歯根膜細胞シート)に培養することに成功しました。動物実験では、この同種歯根膜細胞シートを歯周組織の失われた部分へ移植することにより、良好な歯周組織の再生が確認されました。また、同種由来に細胞に起因する免疫拒絶様反応は観察されませんでした。
なお、歯根膜細胞シートの元となる歯を提供頂いた健康な方には、問診、検査を行い、特定のウイルス(B型・C型肝炎ウイルス、成人T 細胞白血病ウイルス、ヒト免疫不全ウイルス、ヒトパルボウイルス、サイトメガロウイルス、エプスタイン・バーウイルス)及び梅毒に感染していないことを確認しています。
この治験の前には、患者さん自身からいただいた組織片から歯根膜組織に由来する細胞を取り出し、移植可能なシート状の構造を作成して移植する臨床試験(「歯周組織を治すことを目的とし、患者さん自身の歯根膜細胞シートを移植する臨床研究(2011年8月~2014年11月)」)を行いました。この「臨床試験」では、10人の歯周炎患者さんに患者さん自身の歯根膜細胞シートが移植され、大きな問題がないことを確認しています(Iwata et al., Regenerative Therapy 9:38-44. 2018.)。
なお、他の方の歯を利用した歯根膜細胞シート移植による歯周組織の「再生医療」は、この治験が世界でも初の試みとなりますが、現在、細胞シートを用いる治療は、別の分野でも研究が進められており、既に心臓・角膜などの再生に応用されています。
| 用語解説 ●治験 新しい治療法を開発するためには、まず、動物を用いて効果(有効性)や好ましくない作用(副作用)を調べます。その後、実際に健康な成人の方や病気の患者さんに参加していただいて、新しい治療法の効果や副作用を調べる「臨床試験」を行います。その中でも、厚生労働省の承認を得るための成績を集めて、新しい治療法の効果や副作用を調べたり、既に承認されている治療法について、新しい適応症などを調べる臨床試験を「治験」といいます。治験は、新しい治療法の効果や副作用を調べることから、研究的な側面が含まれています。そのため、治験は国が定めた厳しい規則や基準を守りながら、当院の治験審査委員会において、治験の計画内容が科学的及び倫理的に妥当であり、実施に問題がないかを十分に審査され、認められた上で行われています。 ●医師主導治験 この治験は企業が計画する治験ではなく、医師自らが計画・実施する医師主導治験です。2003年の薬事法の改正により、それ以前は認められていなかった医師主導治験ができるようになり、企業が計画しにくい領域の疾患の治療方法に関する治験が行われるようになりました。医師主導治験も企業治験と同様の基準の下で行われ、参加される患者さんの安全や倫理面に十分配慮して行われます。 ●歯根膜由来間葉系幹細胞 成人の歯周組織にも幹細胞が存在することが知られています。我々の研究室で調整された歯根膜由来の幹細胞はいわゆる間葉系幹細胞の特徴を示していることから、歯根膜由来間葉系幹細胞と定義した上で、その自己増殖能と多分可能を確認して細胞バンクを構築しております。 ●歯根膜由来間葉系幹細胞シート(TWP-0001) 冷凍ストックされた同種歯根膜由来間葉系幹細胞を温度応答性培養皿に播種し、一定期間培養後に温度降下処理にて回収されるシート状の組織。 |
PDFはこちら>>
対象患者さんの諸条件の詳細はこちら>>


